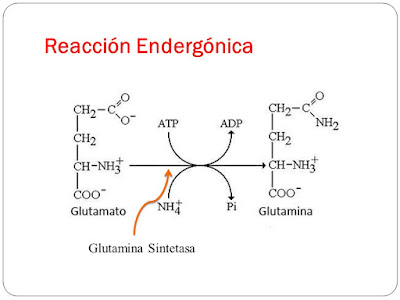
Es aquella que necesita energía para poder realizarse, no es espontánea, y la obtiene del medio ambiente, osea que en lugar de calentarse se enfría.
 |
| José Rojas |
Se caracterizan porque las moléculas de los reactivos tienen menos energía que las moléculas de los productos, por lo cual la variación de energía es mayor que cero.
Por ejemplo:
CaCO3(s) + Calor → CaO(s) + CO2(g)
Aquí el carbonato de calcio (CaCO3) precisa de calor para transformarse en óxido de calcio (CaO) y dióxido de carbono (CO2). (Cuando la energía es absorbida aparece a la izquierda de la ecuación).
Otro ejemplo es la reacción:
2FeSO4 + Calor → Fe2O3 + SO2 + SO3
Donde el sulfato ferroso (FeSO4) más calor se transforma en óxido férrico (Fe2O3), anhídrido sulfuroso (SO2) y anhídrido sulfúrico (SO3).
Otro tipo de reacción endergónica es la que ocurre en la fotosíntesis:
6CO2 + 6H2O + Energía lumínica → C6H12O6 + O2
Que precisa de energía lumínica, dióxido de carbono (CO2), agua (H2O) para producir glucosa (C6H12O6) y oxígeno (O2).
Sus características son:
*Requieren energía calórica para ocurrir.
*Absorben energía.
*Las moléculas de los reactantes tienen menos energía que los productos.
 |
| José Rojas |
No hay comentarios.:
Publicar un comentario